プライマー (生物)
この項目「プライマー (生物)」は翻訳されたばかりのものです。不自然あるいは曖昧な表現などが含まれる可能性があり、このままでは読みづらいかもしれません。(原文:en: Primer (molecular biology)) 修正、加筆に協力し、現在の表現をより自然な表現にして下さる方を求めています。ノートページや履歴も参照してください。(2017年6月) |
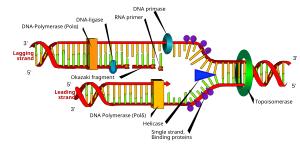
分子生物学において、プライマー (英: primer) とはDNA複製時の起点となる短鎖RNAまたはDNAである。一般に大腸菌などで2〜5ヌクレオチド、真核細胞で5〜8ヌクレオチド、PCRなどで使用する合成プライマーはおおよそ18〜22ヌクレオチド程度である。DNA複製を触媒する酵素、DNAポリメラーゼは既存の核酸の3’末端にヌクレオチドを追加するため、DNA複製過程においてプライマーは必須の要素である。ポリメラーゼはプライマーの3′末端から始め、対向鎖を複製する。
生体内におけるDNA複製は、RNAプライマーと呼ばれるおよそ5ヌクレオチドの短鎖RNAをDNA複製の開始に利用している。これはリーディング鎖の複製時とラギング鎖の複製時とで異なることはなく、人体内にDNAプライマーは存在しない。これらのRNAプライマーを de novo 合成することもできる。
一方、生化学および分子生物学におけるDNAポリメラーゼの関わる(DNAシークエンシングやポリメラーゼ連鎖反応などの) in vitro 実験手法では、DNAプライマーの方が温度安定性が高いので利用される。実験上、結合相手の鋳型DNA鎖と近い融点のプライマーを用いることが重要である場合が多い。アニール温度よりも大幅に高い融点のプライマーはDNA配列中の正しくない場所に分子交雑し伸長するおそれがあり、融点がアニール温度よりも低いとアニールが失敗し、全く伸長しないおそれがある。人工的なプライマーは、化学的に合成された通常は20ヌクレオチド程度の短いオリゴヌクレオチドである。これが標的DNAに分子交雑し、その後ポリメラーゼによる複製が始まる。
in vivo 反応機構
[編集]ラギング鎖とは、DNA二重螺旋のうち5′末端から3′への方向の分子鎖をいう。したがって、それに相補的な分子鎖は 3′→5′ 方向に合成する必要がある。DNAポリメラーゼ III は 3′→5′ 方向への合成は行えないため、ラギング鎖の複製は岡崎フラグメントと呼ばれる短い部分ごとに合成される。ラギング鎖の鋳型に沿って、DNAプライマーゼがRNAプライマーを一気に構築する。その後、DNAポリメラーゼはRNAプライマーの遊離3′-OH基から 5′→3′ 方向にDNA合成を行う。
その後、RNAフラグメントは原核生物の場合はDNAポリメラーゼ I により、真核生物の場合はDNAポリメラーゼ δ により(異なる機構により)除去され、RNAが存在した部分の隙間を埋める新しいデオキシリボヌクレオチドが導入される。そしてDNAリガーゼがデオキシリボヌクレオチド同士を結合させ、ラギング鎖の合成が完了する。
プライマー除去
[編集]真核生物におけるプライマー除去では、DNAポリメラーゼ δ が岡崎フラグメントを5′→3′ 方向に伸長し、上流の岡崎フラグメントを開始させたRNAプライマーに行き当たったところでプライマーの5′末端を単分子鎖RNAフラップに置換し、ヌクレアーゼ開裂によりこれが除去される。RNAフラップの開裂はフラップ構造特異エンドヌクレアーゼ 1 (FEN1) による短フラップの開裂、もしくはDNA結合複製タンパク質A (RPA) による長フラップのコーティング後にDNA2ヌクレアーゼおよびFEN1 による連続開裂により行われる[1]。
この機構はHIVが自身のゲノムをRNA逆転写により形成されたRNA-DNAから二重鎖DNAへと変換する方法を説明する可能性がある。しかし、HIVにコードされている逆転写酵素はセンスcDNA鎖からアンチセンスDNA鎖を複製し二重鎖DNA中間体を作るDNA依存性DNAポリメラーゼ活性のほかにも、それ自体がcDNA合成中にウイルス由来RNAを劣化させてしまうリボヌクレアーゼ活性をもつ[2]。
合成プライマーの利用
[編集]
DNAシークエンシングはDNA鎖内に存在するヌクレオチドを決定する手法である。サンガー法ではプライマーを連鎖反応の開始に用いる。
PCRでは、増幅対象となるDNAフラグメントの特定にプライマーが用いられる。プライマーの長さは通常は30ヌクレオチド以下(18〜24 であることが多い[3]) であり、増幅対象DNAフラグメントの最初と最後にマッチする必要がある。これらは互いに直接複製しあう。あるプライマーがポリメラーゼにより伸長すると今度はそれが鋳型となり、指数関数的に標的セグメントを増幅することができる。
プライマーが常にDNA合成のために用いられるわけではなく、実際にインフルエンザウイルスなどのウイルス由来ポリメラーゼにおいてRNA合成に用いられていることは注意に値する。
PCRプライマー設計
[編集]プライマー対は、それぞれに対してアニーリングが同時に行なわれるため、似た融点を持つ必要がある。融点 Tm が反応のアニーリング温度よりも大幅に高いプライマーは誤分子交雑を起こし誤った場所で伸長するおそれがあり、Tm がアニーリング温度よりも低い場合はアニールに失敗し伸長が全く起こらないおそれがある。
プライマー配列はDNA領域を一意に選択できるよう、近傍の類似配列との誤分子交雑の可能性を避けられるように決める必要がある。普及している手法はBLASTサーチと呼ばれ、プライマーが結合する可能性を持つ領域を表示することができる。ヌクレオチド配列とプライマー配列の両方をBLASTは検索することができる。NCBIによるフリーなツール、Primer-BLAST はプライマー設計とBLASTサーチを一つのアプリケーションに統合しており[4]、同様の商用ソフトウェア製品として ePrime や Beacon Designer が挙げられる。プライマー設計を支援するために、PCRの理論的結果をコンピュータシミュレーション(電子PCR)が行われることもある[5]。
特定のPCR応用用途のプライマー設計向けには多数のフリーなオンラインツールが利用可能である。有名なツールとして、幅広い特徴にマッチするプライマーを見つけることのできる Primer3Plus や PrimerQuest が挙げられる。GeneFISHER を使えば、多様な鋳型DNAを標的とすることのできる高縮退度プライマーをインタラクティブに設計することができる。DECIPHER を使えば、多数の類似DNAの存在下でいくつかの特定の鋳型DNAに対して選択性の高いプライマーを設計することができる。
モノヌクレオチドおよびジヌクレオチド反復はループ形成を起こし、誤分子交雑に寄与しうるため避けるべきである。プライマーは混合された別のプライマー(同配列の別分子鎖と逆配列のものと両方)と容易にアニールするべきではない。この現象はプライマーダイマーと呼ばれる夾雑物を生じさせるおそれがある。加えて、内部ヘアピン構造やループの形成は鋳型DNAとのアニーリングを妨げるおそれがあるため、自分自身とのアニールが強くてもいけない。
TAクローニング用のプライマー設計時には、5′末端と3′末端にAGテールを追加することで効率を向上させることができる[6]。
逆プライマーはcDNA配列の逆相補配列を持つ必要がある。逆相補配列はオンライン計算サービスなどで容易に決定できる[7]。
縮退プライマー
[編集]「縮退プライマー」が用いられる場合もある。これは、実際には類似しているが同一ではない複数のプライマーの混合物である。別々の生物から同一遺伝子を増幅する際、それらは類似しているが同一ではないため縮退プライマーが便利である。縮退プライマーの別の用途としては、タンパク質のアミノ酸配列に基いたプライマー設計を行いたい場合が挙げられる。一つのアミノ酸には複数のコドンが対応するため、実際にどのコドンが使われているかを推論することは困難である。したがって、コドン表によればイソロイシンに対応するプライマー配列はIUPACの定める縮退塩基表記を用いて "ATH" である。すなわちAはアデニン、Tはチミン、Hはアデニン、チミン、シトシンのどれかに対応する。縮退プライマーを用いると、PCR増幅の選択性が大きく下がることがある。この問題はタッチダウンPCRを用いることにより部分的に解決できる。
「縮退プライマー」は微生物生態学において極めて有用であり、広く用いられている。これにより未培養の微生物からの遺伝子増幅や遺伝情報の知られていない生物からの遺伝子回収が可能となる。通常、縮退プライマーは GenBank にある遺伝子配列を整列させて設計される。個々の塩基にIUPAC縮退塩基表記を用いることにより配列間の違いを取り入れることができる。設計後、PCRプライマーはそれらの順列全ての混合物として合成される。
このようなプライマー予測を実行できるプログラムとしては次のようなものが挙げられる。
- CODEHOP: サーバー上で走らせることができるが、サーバーは停止している。ブロックフォーマットを用いる。
- HYDEN: windows 上でコマンドプロンプトから実行する実行可能ファイルとして提供される。
- iCODEHOP: これもブロックフォーマットを使うが、サポートが停止された。
- FAS-DPD: 最近の Java アプリケーション。
関連項目
[編集]- オリゴヌクレオチド合成 - プライマー合成に用いられる手法
出典
[編集]- ^ Distinguishing the pathways of primer removal during Eukaryotic Okazaki fragment maturation Contributor Author Rossi, Marie Louise.
- ^ Doc Kaiser's Microbiology Home Page > IV. Archived 2010年7月26日, at the Wayback Machine.
- ^ S. Patricia, Stock; John, Vanderberg; Itamar, Glazer; Noel, Boemare (2009). “1.6.2. Primers development and virus identification strategies”. Insect Pathogens: Molecular Approaches and Techniques. CAB International. p. 22. ISBN 978-1-84593-478-1. "Specificity is influenced by the length of the primers and typically primers between 18–24 nucleotides are suitable for PCR."
- ^ Primer-BLAST
- ^ “Electronic PCR”. NCBI - National Center for Biotechnology Information. 13 March 2012閲覧。
- ^ Adenosine added on the primer 50 end improved TA cloning efficiency of polymerase chain reaction products, Ri-He Peng, Ai-Sheng Xiong, Jin-ge Liu, Fang Xu, Cai Bin, Hong Zhu, Quan-Hong Yao
- ^ Reverse Complement Calculator
